
遺伝子とデータを使って、病気を予防・治療する社会
見える前に見つける!?
がんの「超」早期発見に向けて
期待されるがんの「超」早期発見
厚生労働省の人口動態統計を見ると、1981年以降日本人の死因第一位は継続して悪性新生物(がん)で、2018年には死亡総数の27.4%をがんが占めています。つまり、全死亡者の約3人に1人ががんで亡くなっていることになります※1 。
がんを克服するため、世界中で数多くの医薬品の開発や治療法の研究が進められています。中でも、近年メディアに大きく取り上げられた話題が二つあります。
一つは「がん免疫療法」です。2014年に小野薬品工業が、免疫チェックポイント阻害剤として「オプジーボ(ニボルマブ)」を日本で上市し、その高額な薬価と併せて大きな話題になりました。その後、アメリカの製薬会社メルクの「キイトルーダ(ペンブロリズマブ)」など、いくつかのチェックポイント阻害剤が上市され、現在は薬の対象となるがん種の拡大や、化学療法薬との併用に関する臨床試験が数多く進んでいます。
もう一つは「がん遺伝子パネル検査」の保険適用です。これは、がんの遺伝子変異によって患者を層別化し、患者ごとに最適な治療方法を提示する精密医療(Precision Medicine)を行う検査システムです。2018年4月以降、厚生労働省はこういった「がんゲノム医療」を提供するための体制作りを進め、全国で順次がんゲノム医療中核拠点病院や、がんゲノム医療拠点病院、がんゲノム医療連携病院が指定されています。さらに、がんの複数の遺伝子変異を一度に検査し、患者ごとのがんの特徴を知り治療に役立てる「遺伝子プロファイル検査」も保険適用されました。具体的には2019年6月に国立がん研究センターとシスメックスが共同開発した「OncoGuide™ NCCオンコパネルシステム」と、中外製薬の「FoundationOne®CDx がんゲノムプロファイル」が挙げられます。今はすべての患者がゲノム検査を受け、適切な薬が見つかるといった段階ではありませんが、臨床試験ではなく、保険診療の中でゲノム検査が受けられるようになり、日本のがん治療は大きな転換期を迎えています。
このような免疫療法や精密医療を中心に、がんの新たな医薬品や治療方法が盛んに研究・開発されていますが、依然として進行したがんの克服は困難です。例えば大腸がんの場合、臨床病期が「限局(がんが原発臓器に限局しているもの)」であれば「5年相対生存率」は9割以上ですが、「領域(所属リンパ節に転移があるか隣接臓器・組織に浸潤している)」では7割程度、さらに進行した「遠隔」では2割以下と、がんの進行に伴って予後は顕著に不良となります※2。がんの克服には、治療法の開発だけでなく、早期発見が不可欠です。しかし、現在のがん検診では早期がんを見落とす可能性があるという指摘があります。さらには時間的・身体的負担が大きいこともあって、がん検診の受診率がそもそも低いという課題もあります。負担の少ない早期発見技術が求められます。
現在、がんの克服のために、血液中のDNA、RNAや、尿の臭いを使った簡便かつ「超」早期発見技術の研究が、企業や研究機関で行われており、いくつかの技術は実用化が近づいています。その技術をそれぞれ見てみましょう。
miRNA
がんの「超」早期発見の技術として注目されているのが「マイクロRNA(miRNA)」です。生物の設計図であるDNAは、RNAを介してタンパク質へと翻訳され、そのタンパク質が細胞の内外で機能することでさまざまな生体現象が誘導されます。一方で、miRNAは短いRNA断片で、タンパク質に翻訳されることなく機能し、生体現象の調節役として多くのタンパク質の発現制御に寄与することがわかっています。近年の研究では、がん細胞は発生初期からがん種ごとに特有のmiRNAを細胞外に放出し、血液に乗って体内を循環すると報告されています。つまり、がん種に特有のmiRNAの有無を調べれば、がんの罹患(りかん)有無を判断できるのです。miRNAは、後述する「血中循環腫瘍DNA(ctDNA)」よりも早期に細胞外に放出されるため、より早い段階でがんの有無を判断できると言われています。
現在、血液からmiRNAを捕捉・測定することで、画像診断では発見が難しいレベルの腫瘍を見つける検査手法の開発が進められています。東京医科大学の落谷教授のグループは、国立がん研究センターのがん検体と国立長寿医療研究センターの健常人検体のバイオバンクを活用し、乳がん、大腸がん、肺がんなどではそれぞれ数千検体、健常人では2万検体の解析を行いました。その結果、5大がん(胃がん、大腸がん、乳がん、肝がん、肺がん)を含む13のがん種を対象として、がん種ごとに3~10種程度の特有のmiRNAが同定されました。すなわち、血中のがん種別ごとのmiRNA群の量によって、患者がどのがんに罹患(りかん)しているかを判断することが可能となったのです。例えば卵巣がんでは、10のmiRNAを調べることによって感度99%、特異度100%という精度で卵巣がんの有無を判断できることが示されています※3。この技術は、東レとの共同開発による検査キットとして開発が進んでおり、すでに膵(すい)がん、及び胆道がんを対象とした検査キットは国の先駆け審査制度に指定されました。さらに、miRNAは、尿にも含まれることがわかっており、血液よりもさらに簡便に検査できる手法の開発も進められています。ごく少量の血液からがんを超早期に発見できる画期的ながん検査の登場は、間近に迫っています。
ctDNA
「血中循環腫瘍DNA(circulating tumor DNA: ctDNA)」は、がん細胞が細胞死する際に細胞外に放出され、血中を循環するがん細胞由来のDNA断片です。このctDNAからその由来となったがん細胞の特徴を知ることができます。現在臨床研究が行われている一部の遺伝子プロファイル検査は、このctDNAからがん細胞の持つ遺伝子変異を解析し、治療方針の決定に貢献します。
ctDNAはがんの発見にも利用されています。アメリカのスタートアップ企業GRAIL(グレイル)社は、がん化によって組織ごとに特有に生じるctDNAのメチル化パターンの異常を同定しました。これは、患者の血中のctDNAを検査することで、がんの有無とその原発部位を特定できることを意味します。米国臨床腫瘍学会(ASCO)の学会「Breakthrough 2019」では、GRAIL(グレイル)社が開発する技術は、すべてのステージを対象にし、5大がんを含む20種類以上のがんをカバーした試験において、特異度が99%(すべてのがん種における総合的な偽陽性率が1%)であると報告されました。がん種を問わず感度は59〜86%で、ステージ別にみると、ステージIで34%、ステージIIで77%、ステージIIIで84%、ステージIVでは92%となっています。さらに、全症例のうち、94%においてがんの原発部位が特定され、そのうち90%が正しい原発部位を提示できていたとのことです※4。
ctDNAは、miRNAと同様に血液を採取するだけで複数のがん種の有無を調べられることから、患者の負荷が軽減された大変魅力的な検査です。ただし、血液には多くのDNA断片が含まれており、ctDNAはごく微量なため、ctDNAを解析するためには検出感度の高い検査が必要です。微量なctDNAを検出するためのさらなる技術開発が期待されます。
線虫
「線虫」とは、体長1ミリ程度で実験のモデル動物としても使われる生物です。この線虫が尿から発せられる臭いをかぎ、がんの有無を教えてくれるという検査が2020年1月から実用化されました。医療ベンチャー企業のHIROTSUバイオサイエンスが開発したこの検査は、尿の臭いに対する線虫の反応(がんがある場合には尿に誘引される、がんがない場合には尿を忌避する)を利用して、全身の15種類のがんリスクがわかるという一次スクリーニング検査です。尿検査のため患者への負担が非常に軽く、安価であることも特徴です。2019年9月現在、感度は85%で、ステージ0~1という早い段階でもがんの有無を調べられると報告されています。ただし、これはあくまで一次スクリーニング検査のため、15種類のどのがんに罹患(りかん)したかは判断できず、検査でリスクが高いと判定された場合は、がんの部位を特定するための二次検査を受ける必要があります。
尿検査は、患者から見た検査ハードルも低く、検査してみようという気持ちになれる手軽さがあります。さらに、検査費用も安価なことから、がんの検査とは距離のある若い世代の検診を促せる可能性があります。線虫という小さな生き物が、がん検査と私たちの架け橋となってくれるのかもしれません。
がん検査はより身近な存在へ
血液や尿を使った患者負担の少ない検査方法の登場によって、がん検査がより身近になる時代が近づいています。実現すれば、新規罹患(りかん)者の発見だけではなく、一度がんを患った方の再発検知の点でも検査の負担を軽減でき、がん治療全体に大きく貢献することでしょう。がんの克服に近づくために、「新たな治療方法の開発」「患者ごとに最適な治療を提供するための検査」「正確・簡便にがんを見つけられる方法の開発」がより一層進んでいくことが期待されます。
なお、miRNAは認知症との関係についても報告がされており、認知症患者のスクリーニングや確定診断においてmiRNAが役立てられる可能性もあります。このように、がんの「超」早期発見を起点として生み出された技術が、今後新たな領域へ拡大していくことにも期待しましょう。
超早期発見による効果
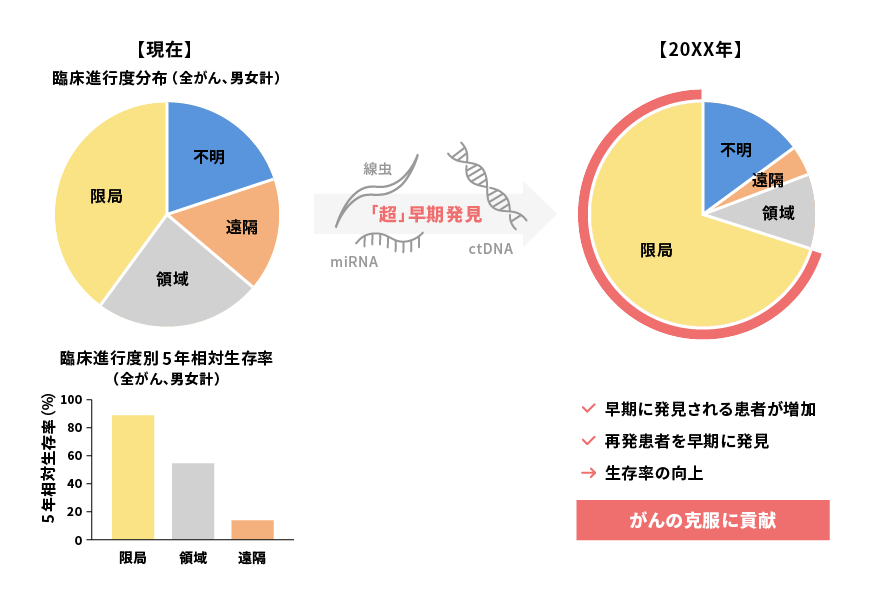
出所:公益財団法人 がん研究振興財団「がんの統計’18」をもとに三菱総合研究所作成
-
※1:厚生労働省「2018(平成30)年人口動態統計」https://www.mhlw.go.jp/toukei/saikin/hw/jinkou/kakutei18/index.html
(閲覧日:2020年年2月26日) -
※2:公益財団法人 がん研究振興財団「がんの統計’18」 https://ganjoho.jp/data/reg_stat/statistics/brochure/2018/cancer_statistics_2018.pdf
(閲覧日:2020年2月26日) - ※3:Yokoi A., et al., Nat Commun. 2018 Oct 17;9(1):4319., Integrated extracellular microRNA profiling for ovarian cancer screening.
- ※4:G. Oxnard, et al., ASCO Breakthrough 2019, Simultaneous multi-cancer detection and tissue of origin (TOO) localization using targeted bisulfite sequencing of plasma cell-free DNA (cfDNA).
