新型コロナ(COVID-19)収束シナリオ 第2回:新型コロナと治療薬・ワクチンの動向
人気の記事
タグから探す
POINT
- 重症化しやすいCOVID-19ウイルスの治療薬開発の見通しは不透明であり、感染を抑えることが重要である。
- 変異株の出現で、感染力、病原性、ワクチンへの感受性が変化することが脅威となるため、変異の機会を抑制し感染拡大を防ぐべき。
- 社会全体でワクチン接種を進めれば「感染しにくい集団」になるが、ワクチンにはリスクも伴うため、接種前にリスクとベネフィットの両面を理解する必要がある。
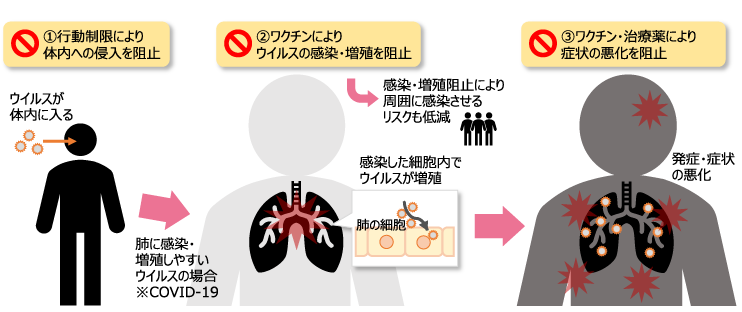
1. COVID-19はなぜ恐れられているのか
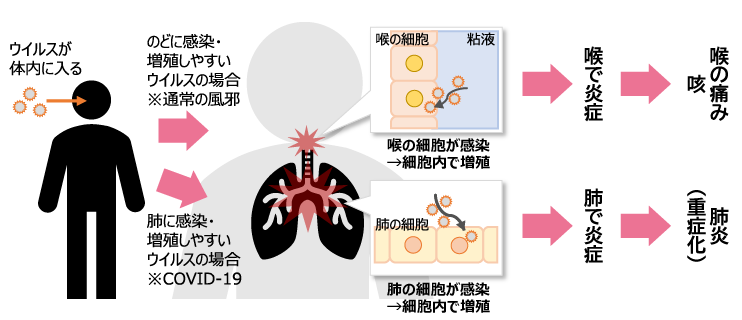
ヒトの細胞は自己増殖するが、ウイルスは、自身で増殖することができない。そこで、生物の細胞の中に侵入し、感染した生物の生体システムを利用することによって自身を増殖させる。この感染・増殖が喉の細胞で発生するとウイルスに抵抗するための炎症反応が喉で起き、痛くなる。肺までウイルスが到達し、肺の細胞に感染・増殖すると肺炎を発症し重症化する(図1)。
COVID-19を引き起こすウイルスであるSARS-CoV-2は、通常の風邪の原因となるコロナウイルスよりも肺の細胞に感染・増殖しやすい※2ため、肺炎を起こしやすい。肺炎が起こると、対症療法として炎症を抑える処置くらいしかできず、治療は困難である。従って、肺炎になる前に感染者の体内におけるウイルスの増殖を抑える、もしくは感染自体を予防することが重要となる。
2. 治療薬への期待と現状
治療薬の3つの作用機序と開発動向
一方で、例えば抗インフルエンザ薬は、感染者の体内でインフルエンザウイルスに直接作用し、増殖させないことで、症状を抑えるものである。COVID-19に対してもウイルスの増殖を抑える治療薬の開発は進められており、①侵入抑制、②増殖抑制、③放出阻害と大きく3つの作用機序(生体に作用する仕組み)のタイプが存在する(図2)。
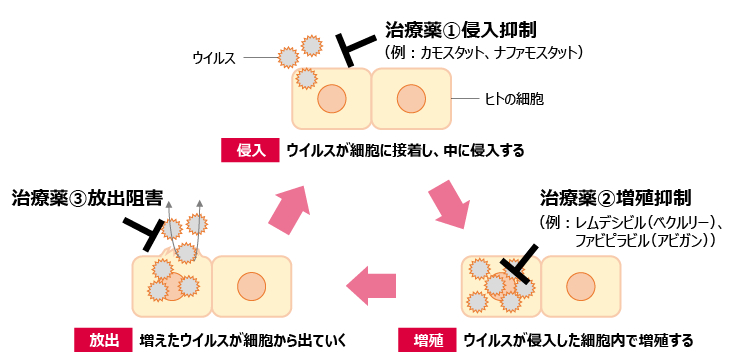
ウイルスがヒトの細胞に接着し、細胞内に侵入することを抑制する。ウイルスはヒトの細胞内に侵入できなければ増殖できない。
②増殖抑制
細胞内に侵入したウイルスが自身を構成する遺伝子・タンパク質をヒト細胞内で生成させることを阻害し、ウイルスの増殖を抑制する。もともとは新型インフルエンザ治療薬であり、COVID-19への有効性が検証されている「ファビピラビル(販売名アビガン)」はこのタイプに該当する。
③放出阻害
感染したヒト細胞内において増殖したウイルスが細胞外に放出されるのを阻害する。ウイルスが細胞の外に放出されなければ、体内のほかの細胞に感染できないため、体内での増殖を抑えることができる。抗インフルエンザ薬では、この放出阻害のタイプに該当するノイラミニダーゼ阻害薬(例:タミフル、リレンザなど)の登場によって治療が大きく変化した。
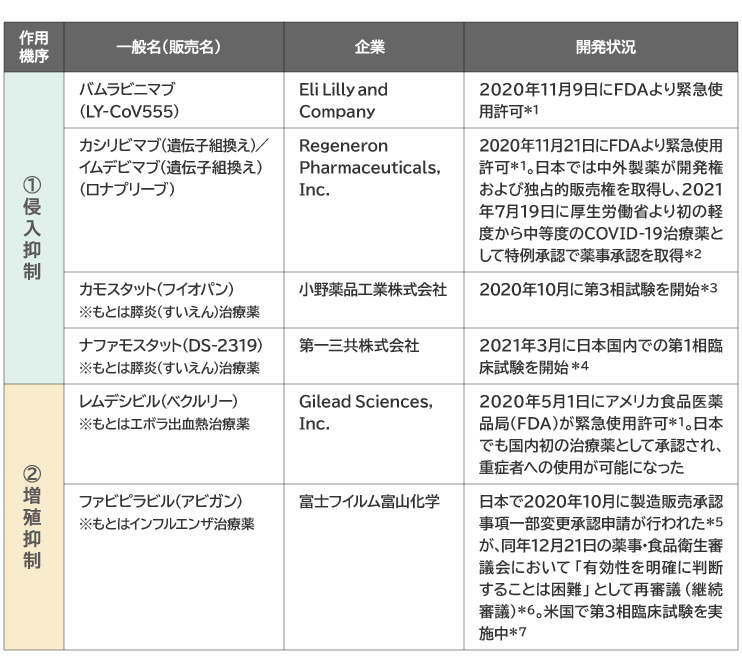
COVID-19においても、原因となるSARS-CoV-2ウイルスに対して①~③に該当する効果を持った治療薬の開発を達成することが治療法確立のポイントとなる。現在は、①と②について開発が進んでおり、その状況を表1に示す。
https://www.fda.gov/
https://www.chugai-pharm.co.jp/
https://www.ono.co.jp/
https://www.daiichisankyo.co.jp/
https://www.fujifilm.com/
https://www.mhlw.go.jp/
https://www.appilitherapeutics.com/
経口投与など自宅で服用可能な治療方法も鍵
経口投与が可能となれば、感染者が病院外でも安全に服薬できるため、軽症患者の入院を減らすことにつながる。経口投与可能な治療薬の登場は、COVID-19の治療に大きな転換をもたらすと考えられる。
新たな治療薬が登場するも、流通を含めて見通しは現時点では不透明
レムデシビルの承認から1年以上が経過した2021年7月19日、初の軽度から中等度のCOVID-19治療薬として、抗SARS-CoV-2モノクローナル抗体であるカシリビマブ(遺伝子組換え)/イムデビマブ(遺伝子組換え)(販売名ロナプリーブ:点滴投与)が国内において特例承認で薬事承認を取得した※6。重症化抑制が期待される治療薬であり、今後のCOVID-19の治療に大きく影響を及ぼす可能性がある。ただし、流通量は限られており、まずは入院患者が対象となる※7ため、外来を含めて幅広く利用されるまでには時間を要する。
その他にも、作用機序、投与方法の面で複数の開発が進められている。通常、承認された治療薬に対する安全性・有効性の評価から承認に至るまでには長い時間を要する。期待されていた治療薬であっても治験において有効性を示すことができない場合もあるため、他の治療薬の完成時期やその有効性の度合いに関しては、現時点では不透明である。そのため当面は、行動制限などにより感染者を増やさないことが重要であろう。
なお、当社がネットワークを有する感染症、公衆衛生などの専門家に対して行ったアンケート調査※8では、「新型コロナウイルスの複製は発症後すぐにピークとなり、減衰局面になるので、良い抗ウイルス薬が開発されても効果を得ることが難しい。感染予防的な使用法の方が期待できる」(微生物学・疫学の専門家)という、治療薬への懸念を示すコメントもみられた。
3. ワクチンの特徴と接種の意義
ワクチンの接種により個人の予防効果が高まる
つまり、ワクチンを使って事前にウイルスの情報を身体に覚えさせることで、実際に感染した場合に素早く反応できるよう準備するのである。感染に対して素早く反応できれば、体内でウイルスが増える前に排除できる可能性が高まり、発症予防や重症化予防の効果が期待できる。
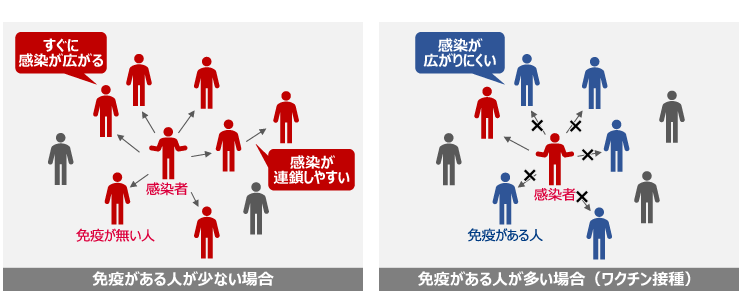
ワクチンは社会全体を感染から守る
集団の中には、アレルギーなどの問題でワクチンを接種できない人もいれば、ワクチンの適応対象になっていない子どももいる。集団免疫を獲得できれば、ワクチンを接種できない人たちも感染から守ることができる(図3)。
集団免疫の獲得に必要なワクチン接種率は感染症によって異なる。2020年8月に示されたWHOの推計によれば、COVID-19のワクチンによって集団免疫の状態を獲得するには、人口の約60~70%がワクチンを接種する必要があるとされている※9。
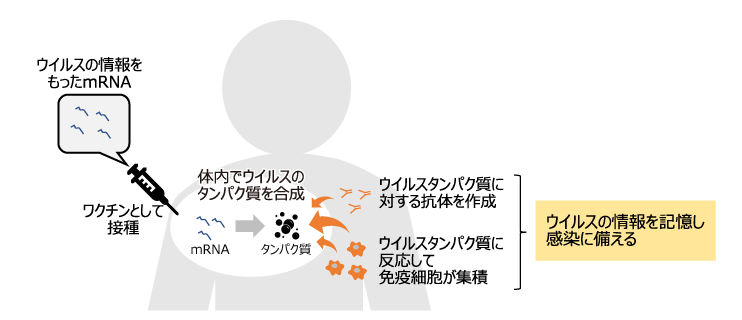
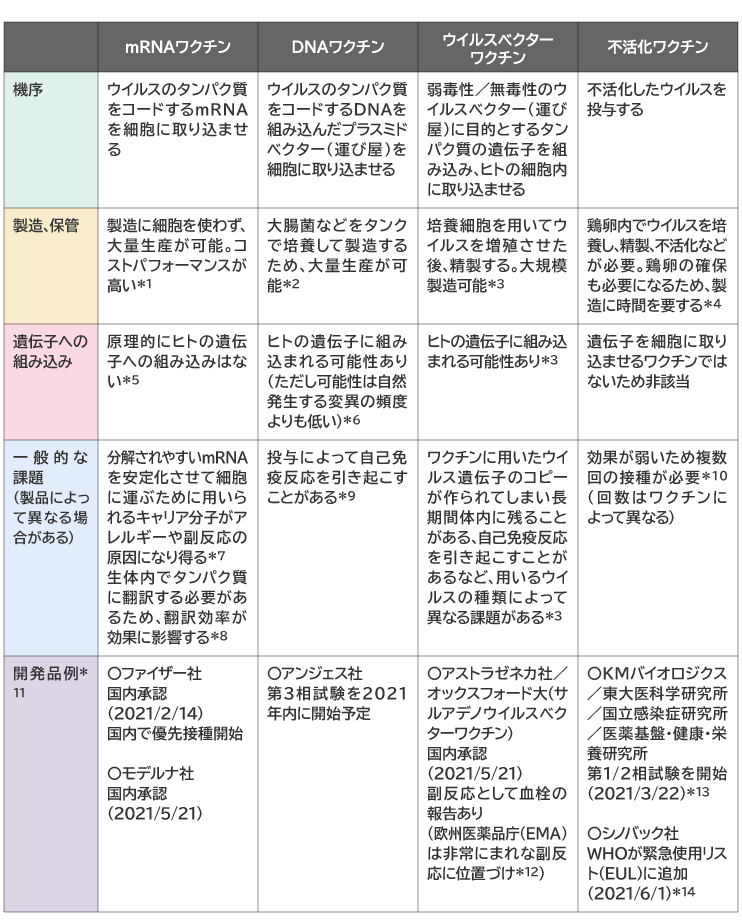
4. 現在接種が進められているCOVID-19ワクチン
これを接種すると、mRNAの情報を基に、体内で新型コロナウイルスのタンパク質が合成される。人の体内で合成されたウイルスのタンパク質によって、身体はウイルスが侵入したと勘違いし、そのタンパク質に対する免疫反応が引き起こされる(図4)。
https://www.cdc.gov/
https://www.pfizer.com/
https://www.igakuken.or.jp/
https://www.primate.or.jp/
https://www.rnaj.org/
https://www.niid.go.jp/
https://www.hhs.gov/
https://www.mhlw.go.jp/
https://www.mhlw.go.jp/
https://www.kmbiologics.com/
https://www.who.int/
出所:各種資料を基に三菱総合研究所作成
早い時期から接種が開始された諸国では、mRNAワクチンの有効性に関するデータが集積しつつある。ワクチン接種が進むイスラエルは、ファイザー社のmRNAワクチンを2回接種してから14日後以降の有効性を検証しており、発熱や呼吸器症状を伴う病気の予防、COVID-19による入院や重症化の予防、COVID-19による死亡を予防する点いずれについても、98%以上の高い効果を示した※14※15。
また、米国CDCは2020年12月~2021年3月に医療従事者や救急隊員、エッセンシャルワーカーを対象とした調査を実施し、ファイザー社とモデルナ社のmRNAワクチンの有効性を確認している※16。本調査により、ワクチンの2回目接種から14日以上経過すると、感染リスクが90%減少するというデータが出ている。
mRNAワクチンの効果が示される一方で、副反応も報告されている。5月26日の厚生科学審議会予防接種・ワクチン分科会副反応検討部会における報告によれば、日本ではファイザー社のワクチン接種に関連して、発熱や接種部位の腫れなどの軽度な副反応のほかに、重篤な副反応であるアナフィラキシーが100万回接種あたり24件(2021年2月17日~5月16日)報告されている※17。加えて米国FDAによると、特に2回目の接種の方が、副反応が起こる頻度が高い※18。
ワクチンのリスクとベネフィットを理解する
先に述べたように、COVID-19ワクチンの接種後に発熱などの副反応が起こることが報告されており、まれに重篤な副反応が起こるケースもある。米国では、COVID-19ワクチンの接種後に起こる有害事象を「ワクチン有害事象報告システム(VAERS)」を通じて収集しており、2020年12月14日~2021年6月21日に5,479件の死亡報告があった(接種数全体の0.0017%、ただしワクチンとの因果関係が示されていないケースも含む)※19。
一方で、ワクチンを接種することによりCOVID-19に罹患(りかん)する確率や重症化リスクが低減すれば、高齢者や基礎疾患のある人はCOVID-19による死亡を回避できる可能性がある。WHOは「副反応のリスクの方が、ワクチンを接種せずにCOVID-19にかかるリスクよりもはるかに小さい」としてワクチン接種を推奨している※20。
ただし、各国でCOVID-19ワクチンの接種が進められているものの、現時点では正規の「承認」が下りた上で使用されているワクチンがない点は、注視する必要があるだろう。現在、日本の医薬品医療機器総合機構(PMDA)が承認しているCOVID-19ワクチンは3種類あるが、いずれも「特例承認」されたものである。特例承認とは、①疾病のまん延防止などのために緊急の使用が必要、②当該医薬品の使用以外に適切な方法がない、③海外で販売などが認められている、といった医薬品について、臨床試験以外の承認申請資料を承認後の提出としても良いなど、特例的に承認する制度である※21。
特例承認の条件として「③海外で販売等が認められている」とあるが、日本より先にCOVID-19ワクチンの使用を開始した欧米諸国においても、正式な承認が下りた上で使用されているわけではない。EUの欧州医薬品庁(EMA)が承認しているCOVID-19ワクチンは現在4種類あるが、いずれも「条件付き製造販売承認(Conditional Marketing Authorisation; CMA)」である※22。
CMAとは、アンメットメディカルニーズを満たす医薬品を迅速に利用可能にするために、通常必要とするデータがそろっていない段階でも、1年間の期限付きで販売を認める制度である※23。CMA承認が得られた後も、引き続き総合的な臨床データの収集が義務付けられる場合があり、もしベネフィットがリスクを下回ると認められた場合には販売承認の一時停止や取り消しの可能性もある。
加えて、米国FDAが承認しているCOVID-19ワクチンは現在3種類あるが、いずれも「緊急使用許可(Emergency Use Authorization; EUA)」である。EUAとは、パンデミックなどの緊急事態に対応するために、未承認の医薬品の使用を許可する制度である※24。FDAはEUAで使用が認められたワクチンを接種した人々を継続的に追跡する必要性を示すとともに、それらのワクチンの製造販売者は、正式な承認を得るために今後も臨床試験を継続して安全性・有効性を検討していく必要があると述べている。
mRNAワクチンではないが、アストラゼネカ社のウイルスベクターワクチンを接種することによる副反応として、血栓症が問題となった。その際、英国医薬品・医療用製品規制庁(MHRA)とEMAによる調査が行われ、最終的には、本ワクチンのCOVID-19に対する予防効果は高く、ベネフィットはリスクを上回ると結論付けられた。しかし、英国では40歳未満の健康な人々は同社のワクチン以外のワクチンを接種すべきとされている※25※26。
現在は緊急的に使用されているCOVID-19ワクチン、特にmRNAワクチンは新しいタイプであることから、治療薬と同様に今後長期の安全性を検証していく必要がある。
また、このように検証を積み重ねながら接種を進めたとしても、長期的に薬害が発生する可能性はゼロにはできない※27。現時点では予期できない被害が将来発生した場合には、国家による賠償などの措置で対応することが法的に定められている。
リスクとベネフィットを正しく評価し、万一、想定以上の副反応が発生する予兆を早期探知するためにも、引き続きデータの収集が望まれる。
5. 変異を理解し「正しく恐れる」
ウイルスの変異で注意すべきこと
新型コロナウイルスはRNAウイルスに属するが、一般的にRNAは不安定であることや、増える過程でエラーが起こりやすいなどの理由により、RNAウイルスは変異しやすいと言われている。また、増殖の頻度が増すほど、変異が発生する機会が増えるため、そもそも変異株を出現させないためにも、感染拡大を抑制しなければならない。
このように定常的に起こっている変異だが、現在変異株が注視されている理由は何なのか。ウイルスの変異に正しく対処するためのポイントは、ウイルスの①感染・伝播力、②病原性、③ワクチンへの感受性への影響を理解することである。
①感染・伝播力
ウイルスは、細胞に感染・増殖して症状を引き起こし、ヒトからヒトへ伝播する。最も怖いのは、容易に伝播して重篤な症状を引き起こすウイルスということになる。特に注目されているN501Y変異株を含め、現在流行している変異株は、主にウイルスが細胞に侵入するのに必要な、突起状の物質であるスパイクタンパク質の一部に変異が生じている※32。このスパイクタンパク質が細胞に接着しやすい性質に変異した場合、ウイルスの感染力が上がると考えられる。
②病原性
感染したウイルスが増殖するにつれて、体内ではウイルスを排除するための免疫反応が起こる。この反応の起こりやすさはウイルスによって異なり、強い反応を起こすウイルスは病原性が高く重症化しやすいと考えられている。
③ワクチンへの感受性
前述のスパイクタンパク質は多くのCOVID-19ワクチンのターゲットにもなっているが、変異が起こることによってワクチンが効かなくなる懸念もある。ワクチンは、身体に覚えさせた病原体と同じものが侵入してきた場合に効果を示す。すなわち、変異によって病原体の形が変わってしまうと、免疫反応がスムーズに起こらない場合がある。これが、ワクチンの効果が低下する理由である。
2021年3月にフランスで発見された変異株は、既存のPCR検査では検出困難との報告もある。このように、既存の対策を覆す可能性のある変異株の出現は私たちにとって脅威であり、出現してしまった場合には市中感染を広げないよう対策することが必須である。変異株が出現しても、感染拡大を抑えるためにこれまで行ってきた対策を、引き続き実施していくことが重要である。
6. 今後の感染症対策に求められること
このように行動・ワクチン・治療薬がうまくかみ合うことによって、ようやく感染症の収束を迎えることができる。ただし、接種希望者全員にワクチンが行き渡るには時間を要するため、社会としては的を絞った効果的な行動制限が引き続き求められる場面もある。
1年以上の行動制限が続く中、上述の通り治療薬の見通しが不透明である現状において、効果的な対策であるワクチン接種が日々加速している。しかし、最終的に接種するかどうか判断する前に、個々人が自身の状況に応じたリスクとベネフィットを十分理解する必要があるだろう。
※1:厚生労働省厚生科学審議会「新型コロナウイルス感染症について(インフルエンザ等との比較)」(2021年1月15日国立感染症研究所提出資料)
https://www.mhlw.go.jp/
※2:中島典子、鈴木忠樹、足立拓也、鄭子文(2020)「COVID-19剖検例の解析と病理組織像」(IASR Vol. 41 p118-119: 2020年7月号)
https://www.niid.go.jp/
※3:ファイザー社が2021年3月23日に発表。
https://www.pfizer.com/
※4:厚生労働省がサイト上で告知。
https://www.mhlw.go.jp/
※5:WHOが 2020年11月20日付で勧告。
https://www.who.int/
※6:中外製薬株式会社が2021年7月19日に発表。
https://www.chugai-pharm.co.jp/
※7:厚生労働省が事務連絡にて2021年7月20日付で通知。
https://www.mhlw.go.jp/
※8:今後の見通しに関するアンケート調査を実施し、21人から回答を得た。(2021年2月22日~2月28日実施)
※9:WHOが2020年8月28日に発表。
https://www.who.int/
※10:Norbert Pardi、Michael J. Hogan, Frederick W. Porter、Drew Weissman(2018)“mRNA vaccines — a new era in vaccinology” Nature Reviews Drug Discovery volume 17, pages261–279 (2018) (閲覧日:2021年6月2日)
※11:政府CIOポータル「新型コロナワクチンの接種状況:ワクチン接種状況ダッシュボード」
https://cio.go.jp/
※12:CDC、COVID Data Tracker
https://covid.cdc.gov/
※13:European Centre for Disease Prevention and Control、COVID-19 Vaccine Tracker
https://vaccinetracker.ecdc.europa.eu/
※14:Israel, Ministry of Health, Press Releases “Effectiveness Data of the COVID-19 Vaccine Collected in Israel until 13.2.2021”
https://www.gov.il/
※15:ただしこれは限られた期間の有効性データであり、長期間の有効性については引き続き要検討。
※16:CDC Press Release “CDC Real-World Study Confirms Protective Benefits of mRNA COVID-19 Vaccines”
https://www.cdc.gov/
※17:第60回厚生科学審議会予防接種・ワクチン分科会副反応検討部会(資料1-5)「副反応疑い報告の状況について」
https://www.mhlw.go.jp/
※18:U.S. Food & Drug Administration “Pfizer-BioNTech COVID-19 Vaccine”
https://www.fda.gov/
※19:CDC, “Selected Adverse Events Reported after COVID-19 Vaccination”
https://www.cdc.gov/
※20:WHO Malaysia, “Statement on the benefits of vaccines against COVID-19”
https://www.who.int/
※21:厚生労働省「医薬品医療機器等法に基づく新型コロナウイルスワクチンの特例承認について」
https://www.mhlw.go.jp/
※22:European Medicines Agency, COVID-19 vaccines: authorised
https://www.ema.europa.eu/
※23:European Medicines Agency, “Conditional Marketing Authorisation”
https://www.ema.europa.eu/
※24:FDA, “Emergency Use Authorization”
https://www.fda.gov/
※25:アストラゼネカ社プレスリリース 「アストラゼネカのCOVID-19ワクチンに関するMHRAとEMAの決定を踏まえた現在の状況について」
https://www.astrazeneca.co.jp/
※26:Public Health England, “Patient Group Direction for COVID-19 Vaccine AstraZeneca, (ChAdOx1-S [recombinant])” v04.00 (2021年5月12日更新版)
https://www.england.nhs.uk/
※27:ワクチン接種については過去にも、MMRワクチン(麻しん、おたふくかぜ、風しんの三種混合ワクチン)接種により無菌性髄膜炎の被害などが発生した経緯もある。
※28:第69回新型コロナウイルス感染症対策本部
https://www.kantei.go.jp/
※29:アルファ株は従来株の1.32倍の感染力(実効再生産数の期待値)、1.4倍(40-64歳では1.66倍)の重症化率(肺炎以上の症状となるリスク)と推定されている。
※30:第44回新型コロナウイルス感染症対策アドバイザリーボード(資料4①)
https://www.mhlw.go.jp/
※31:英国では、2021年6月27日から7月3日に遺伝子型決定された症例の97%をデルタ株(B.1.617.2 系統および AY.1/AY.2 系統を含む)が占めていたとされている。
※32:CDC “SARS-CoV-2 Variant Classifications and Definitions” (Updated June 4, 2021)
https://www.cdc.gov/
連載一覧
-
2023.8.24次のパンデミックに備える研究・開発の基盤「REBIND」
-
2023.7.6「日本版CDC」を緊急時に機能させるためには?
-
2023.4.25新型コロナ「五類」 次のパンデミックに備える
-
2022.11.15新型コロナが押し開く「プライマリヘルスケア」の扉—ヘルスケアシステムのレジリエンス強化にむけて
-
2022.8.3新型コロナ(COVID-19)収束シナリオ 第4回:感染症の状況に適応した措置のための制度と技術活用を
-
2021.8.5新型コロナ(COVID-19)収束シナリオ 第3回:ロボット・センサー・ICTの活用で「介護のニューノーマル」を加速
-
2021.3.22新型コロナ(COVID-19)収束シナリオ 第1回:見えてきたニューノーマル(新常態)への道筋
関連するナレッジ・コラム
トレンドのサービス・ソリューション
寄稿や講演の依頼などその他のお問い合わせにつきましても
フォームよりお問い合わせいただけます。