今、次のパンデミックが発生したときに、この研究開発が円滑に進むための新たな準備が行われている。
次のパンデミックに備える研究・開発の基盤「REBIND」
人気の記事
タグから探す
今、次のパンデミックが発生したときに、この研究開発が円滑に進むための新たな準備が行われている。
新型コロナの反省から次のパンデミック対策へ
データや検体を保存・管理する「REBIND」が始動
REBINDは新型コロナのような新興・再興感染症に対して、病態解明の研究や、予防法・診断法・治療法の開発などを進めるための基盤として、厚生労働省の主導のもと構築された。臨床情報や検体を全国の医療機関から収集し、ヒトゲノム解析、病原体ゲノム解析や病原体分離を行い、データや検体などを一元的に保存・管理し、利活用者に提供する「ナショナル・リポジトリ」の機能を備える※3。(図1)
REBINDは「感染症の予防及び感染症の患者に対する医療に関する法律(1998年法律第114号)」に基づく国としての公的な事業だ。厚生労働省の委託を受けた国立国際医療研究センター(NCGM)と、国立感染症研究所(感染研)が連携して運用している。NCGMと感染研は統合して「国立健康危機管理研究機構」が創設されることになっており、さらに円滑な運営が期待できる。
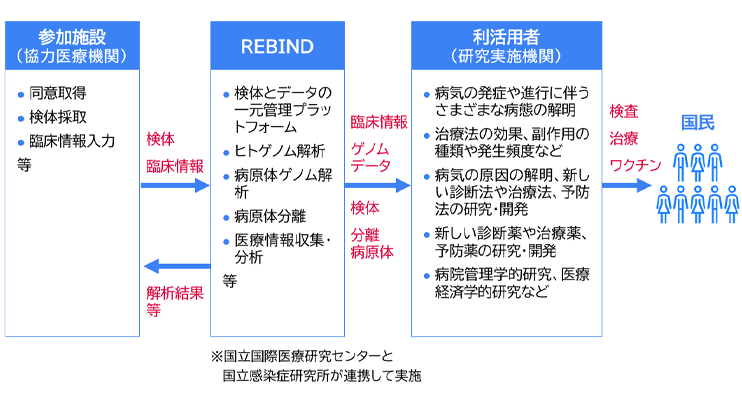
診断法・ワクチン・治療薬・検査機器・システムの開発には患者の検体や病原体が重要である。データだけでは開発はできない。名古屋議定書(正式名称:生物の多様性に関する条約の遺伝資源の取得の機会及びその利用から生ずる利益の公正かつ衡平な配分に関する名古屋議定書)などのハードルもあり、海外から迅速に病原体を得ることは難しい場合も考えられる。国内の公的な機関で迅速にデータ、病原体を確保し、活用できることが公衆衛生対策と研究・開発双方の観点で重要である。
行政の公衆衛生対応で得られた検体は患者の同意が得られていない。このため本来は研究などには直接活用できない。しかしREBINDでは検体、情報、病原体の研究・開発への利用に関して、事前に患者同意が得られている。企業の開発にも利活用可能だ。パンデミックという一刻を争う中で大きなメリットであるといえる。
参加施設の負担軽減へ向けて
しかし2023年6月1日時点のREBIND参加施設数は25施設である。参加施設がない地域や都道府県もある現状を勘案すると、けっして多いとは言えない。現在厚生労働省は、第一種感染症指定医療機関および第二種感染症指定医療機関に対して、当該事業への積極的な参加を呼びかけている(2022年4月28日付事務連絡)※4。この第一種感染症指定医療機関の数は全国で56※5。第二種感染症指定医療機関のうち感染症病床を有する指定医療機関の数は348※6である。これらの第一種、第二種の感染症指定医療機関すべてがREBINDに参加すれば参加施設数は現在の10倍以上となり、すべての都道府県で複数の参加施設が稼働することにつながる。国内のどこで、いつ新しい感染症が発生しても、REBINDが迅速に検体を確保し、提供できる体制が整うこととなる。
参加施設数を増やすには、REBIND参加施設の負担を軽減することが必要である。一般にレジストリに参加すると、医療機関が倫理対応、同意取得、検体採取と管理、保存、梱包と輸送手配、臨床情報の入力などの対応を行うため、相応のマンパワーが必要となる。REBINDは参加施設の負担が一定の範囲で軽減できる仕組み※7が導入されているが、それでも施設内でEDC(Electronic Data Captureシステム)への入力など人手による対応が生じており、運用上の大きな負荷となっていると思われる。臨床情報のEDCへの入力は1症例当たり1~2時間※8要すると言われており、入力以外の同意取得や検体採取、検体処理などの対応をあわせると、1症例の登録に専門人材とその他の人材込みで5時間以上を要するのではないかと推察される※9。当初のREBINDの目標値である1万検体を、仮に現在の10倍の施設数(250施設)で1年を通じて集めた場合、1施設あたり年間40検体の登録となり、1年間でのべ600時間(40検体×3ポイント×5時間)以上の対応時間を要することになるのだ。
負担軽減の方法としては、治験施設支援機関(SMO)を介してREBINDから参加施設に治験業務全般をサポートするコーディネーター(CRC)を派遣し、人的な対応を支援する仕組みを導入するのはどうか——(図2)。年間40検体程度であれば、週に2~3回CRCが勤務すると対応できるのではないだろうか。
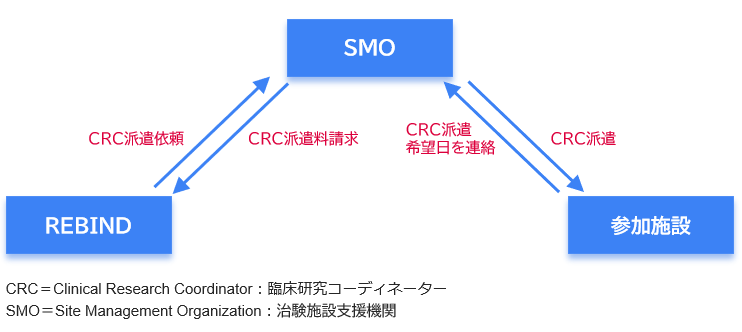
また、パンデミックによって医療機関が多忙な時でもREBINDが機能するためには、REBINDの対応を参加施設内で継続可能とすることも必要である。パンデミック対応で繁忙の中、検体が増加した場合でも対応できるだけの人員を、REBINDからCRCを派遣することで補えるのではないか。
2022年秋からは、新型コロナ以外の感染症への対応も開始された。2022年10月26日付でREBINDの対象感染症にサル痘(エムポックス)が追加となった。平時においてもREBINDを回し続け、課題を見つけ、バージョンアップを行うことで、パンデミックの際に迅速かつ円滑に対応できる仕組みとすることができる。新型コロナやサル痘に限らず、平時でも重要な感染症に対応しながら、パンデミック時に機能する基盤としての役割をREBINDが果たすことが期待されている。
※1:文部科学省 科学技術・学術政策研究所(2021年6月)「新型コロナウイルス感染症(COVID-19)における我が国のワクチン開発に関する課題と対策の抽出」
https://www.nistep.go.jp/
※2:医療科学研究所『医療と社会 Vol.32 No.1』(2022年度)「臨床情報の収集・分析と課題」
https://www.jstage.jst.go.jp/
※3:厚生労働省委託事業 REBINDのご紹介(NCGM)
https://rebind.ncgm.go.jp/
※4:厚生労働省 「厚生労働省新型コロナウイルス感染症対策推進本部 事務連絡」(2022年4月28日)
https://www.mhlw.go.jp/
※5:厚生労働省 「感染症指定医療機関の指定状況」(2022年4月1日現在)
https://www.mhlw.go.jp/
※6:厚生労働省 「第二種感染症指定医療機関の指定状況」(2022年4月1日現在)
https://www.mhlw.go.jp/
※7:倫理審査がNCGMでの中央審査(一括審査)とすることや、同意取得のための説明動画の整備、検体採取キットなどの資材・物品の提供、採取した検体の回収は臨床検査会社が実施することなどが負担軽減策としてすでに実施されている。
NCGM
https://rebind.ncgm.go.jp/
※8:医療科学研究所 『医療と社会 Vol.32 No.1』(2022年度)「臨床情報の収集・分析と課題」
https://www.jstage.jst.go.jp/
※9:国立大学病院臨床研究推進会議 「資料1 料金設定および根拠事例集」
https://plaza.umin.ac.jp/
著者紹介
連載一覧
-
2023.7.6「日本版CDC」を緊急時に機能させるためには?
-
2023.4.25新型コロナ「五類」 次のパンデミックに備える
-
2022.11.15新型コロナが押し開く「プライマリヘルスケア」の扉—ヘルスケアシステムのレジリエンス強化にむけて
-
2022.8.3新型コロナ(COVID-19)収束シナリオ 第4回:感染症の状況に適応した措置のための制度と技術活用を
-
2021.8.5新型コロナ(COVID-19)収束シナリオ 第3回:ロボット・センサー・ICTの活用で「介護のニューノーマル」を加速
-
2021.7.29新型コロナ(COVID-19)収束シナリオ 第2回:新型コロナと治療薬・ワクチンの動向
-
2021.3.22新型コロナ(COVID-19)収束シナリオ 第1回:見えてきたニューノーマル(新常態)への道筋
関連するナレッジ・コラム
トレンドのサービス・ソリューション
寄稿や講演の依頼などその他のお問い合わせにつきましても
フォームよりお問い合わせいただけます。